

(uit ScienceToday)
03/06/2020
De celenvelop van Escherichia coli is moeilijk doorheen te dringen en is een bron van frustratie voor hen die nieuwe antibiotica proberen te vinden tegen deze bacterie. Twee van de drie lagen van de envelop zijn stevig verbonden door een lipoproteïne, Lpp. Door dit Lpp te manipuleren, konden onderzoekers van het de Duve Instituut (UCLouvain) E. coli verzwakken.
Escherichia coli (E. coli) is van nature aanwezig in onze darmen. Ze is een geweldige bondgenoot van ons lichaam en helpt zelfs bij het bestrijden van bepaalde infecties. Waarom dan toch antibiotica ontwikkelen om de bacterie te bestrijden? Omdat bepaalde bacteriestammen pathogeen zijn en buikkrampen en diarree kunnen veroorzaken, soms met ernstige complicaties. Om dit te verhelpen, zijn antibiotica nodig die de bacteriële omhulling kunnen vernietigen, wat niet gemakkelijk is wanneer de bacterie wordt beschermd door een drielaagse wand.
Er zijn veel soorten bacteriën. E. coli is één van de zogenaamde 'gramnegatieve' bacteriën. Ze heeft dus drie beschermingslagen:
Om een pathogene bacterie te vernietigen, moet een medicijn door de beschermingslagen gaan. 'Veel antibiotica proberen de assemblage van laag 2 te verstoren', legt prof. Jean-François Collet, een bacteriespecialist aan het de Duve Institute van UCLouvain, uit. ‘Daarmee zijn we er nog niet! Omdat laag 3 ook erg "stevig" kan zijn, vooral als deze stevig verankerd is aan laag 2. Dit wordt bacteriële stijfheid genoemd.'
In E. coli zijn deze twee lagen verbonden door talrijke kopieën van het lipoproteïne Lpp. Lpp fungeert als een pilaar tussen de tweede wal (laag 2) en de buitenbehuizing (laag 3).
Prof. Collet en zijn team zijn al enkele jaren geïnteresseerd in Lpp. En daarvoor hebben ze goede redenen. 'Het is de lengte van Lpp die de ruimte tussen de lagen bepaalt', legt hij uit. 'Als we de Lpp-pilaren verlengen, verhogen we de facto de 'plafondhoogte' en dus de grootte van de bacterie. Het wijzigen van Lpp verstoort echter bewakingslaag 3. ’
Om dit te begrijpen, kunnen we ons de bacterie voorstellen als een fort. Ze is gevuld met eiwitten die fungeren als soldaten, metselaars of boodschappers. Als de buitenste ommuring (laag 3) wordt aangevallen, moet een boodschapper de andere eiwitten waarschuwen, die vervolgens ingrijpen om de bacterie te verdedigen of de toegebrachte schade te herstellen. Maar als de afstand tussen de buitenmuur en de tweede wal (laag 2) is vergroot, kan de boodschap onderweg verloren gaan. Het bacteriële fort wordt dan doof en blind voor wat het aanvalt.
'We wisten al dat het manipuleren van Lpp de bacteriële stijfheid vermindert en daarom de afweer van E. coli verzwakt', zegt prof. Collet. 'Maar we wilden weten in hoeverre precies.' Om dit te onderzoeken, zijn de onderzoekers E. coli genetisch gaan modificeren, ofwel door Lpp te verlengen of door te voorkomen dat het zich hecht aan laag 2. Vervolgens zocht het team van prof. Collet samenwerking met dat van prof. Yves Dufrêne, FNRS-onderzoeksdirecteur aan het Louvain Institute of Biomolecular Science and Technology (LIBST). ‘Prof. Dufrêne, die ook aan bacteriën werkt, heeft uitgebreide expertise op het gebied van atoomkrachtmicroscopie (AFM). Zijn team heeft de nanoschaalpunt van de microscoop op het oppervlak van natuurlijke en gemuteerde E. coli-bacteriën laten 'lopen' en kracht uitgeoefend totdat ze breken. 'Deze experimenten bevestigden dat het manipuleren van Lpp inderdaad de bacteriële stijfheid vermindert, ongeacht de modificatie (verlenging of loskoppelen). ‘De AFM-experimenten hebben ons vooral in staat gesteld om, voor het eerst, het belang van Lpp voor de stijfheid van de bacteriële envelop te kwantificeren en nauwkeurig te meten.'
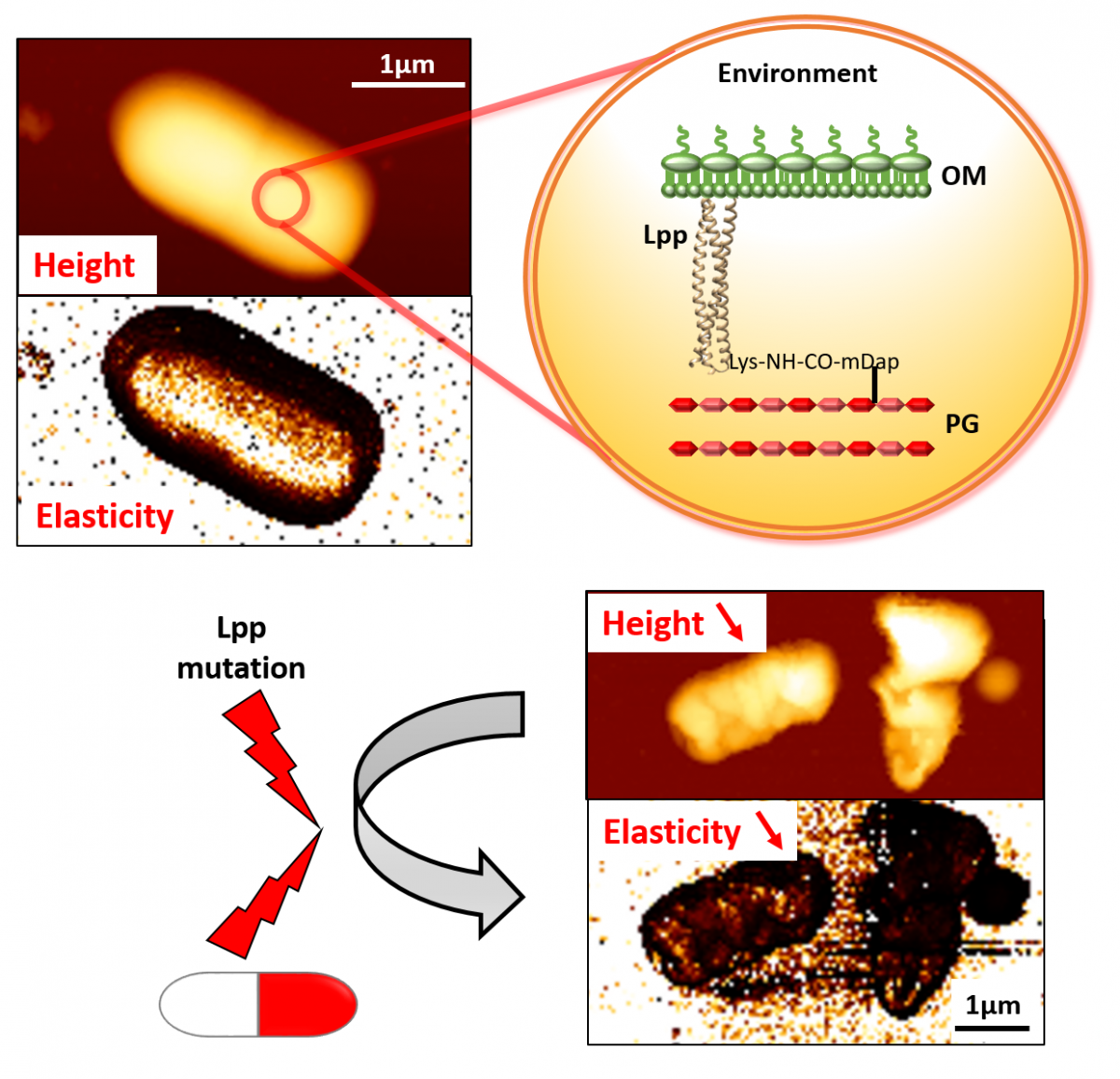 |
| De covalente verankering et de lengte van het lipoproteïne Lpp regelen de mechanische eigenschappen van E. coli en de gevoeligheid voor antibiotica. |
Deze studie was het onderwerp van een artikel in het tijdschrift Nature Communications. 'Nu we deze kwantitatieve gegevens hebben, willen we moleculen vinden die dezelfde effecten op de bacteriële stijfheid kunnen veroorzaken als onze genetische manipulaties', legt prof. Collet uit. 'Dit zijn moleculen die de rijping, productie en/of actie van Lpp kunnen verstoren. Dit zou de bacteriële stijfheid verminderen en ervoor zorgen dat antibiotica gemakkelijker de afweer van E. coli kunnen binnendringen. ' Om het te vernietigen, indien nodig? Dat is de hoop en het pad dat de onderzoekers van UCLouvain hebben verkend.
Artikel over dit onderzoek
Lipoprotein Lpp regulates the mechanical properties of the E. coli cell envelope.
Mathelié-Guinlet M, Asmar AT, Collet JF, Dufrêne YF.
Nat Commun. (2020), 11(1):1789.
Verder lezen
Bacterial Cell Mechanics Beyond Peptidoglycan
Mathelié-Guinlet M, Asmar AT, Collet JF, Dufrêne YF.
Trends Microbiol. (2020), 25:S0966-842X(20)30106-2
Financiering
WELBIO (een Waals interuniversitair onderzoeksinstituut); FNRS ‘Excellence of Science’ (EOS) programma; een deel van de beurzen van de European Research Council (ERC) verkregen door Prof Collet en Prof Dufrêne.