

Het omzetten van voedingsstoffen uit het milieu in energie en biomassa is een fundamentele uitdaging van het leven. Eencellige organismen, zoals bacteriën of gisten, staan in elke cel afzonderlijk voor deze uitdaging. Bij het verwerken van voedingsstoffen, waarvan de beschikbaarheid vaak onbetrouwbaar is, produceren ze echter metabolieten die werken als communicatiesignalen bij het aanpassen aan omgevingsstress of om de groei te coördineren. Een belangrijk voordeel van meercelligheid is het vermogen van cellen om metabool te diversifiëren en samen te werken, waarbij metabolieten die in het ene celtype worden geproduceerd door een ander als voedingsstof worden gebruikt. In complexe organismen zoals zoogdieren worden metabolieten nog steeds gebruikt voor cellulaire communicatie, maar de omvang en het belang van deze interacties is niet goed begrepen.
Een voorbeeld van een weefsel waarin diverse celtypen samenwerken is het beenmerg, waar dagelijks 200 miljard rode bloedcellen, 10 miljard witte bloedcellen en 400 miljard bloedplaatjes worden aangemaakt. De juiste werking van dit proces is niet alleen afhankelijk van bloedstamcellen, maar ook van hun interacties met andere celtypen in het beenmergmilieu, zoals botcellen, bloedvatcellen, immuuncellen en bindweefselcellen, gezamenlijk aangeduid als de beenmergniche. De beenmergniche is ook betrokken bij de ontwikkeling en groei van bloedziekten zoals leukemie, waarbij bloedstamcellen ongecontroleerd beginnen te groeien en niet langer normale bloedcellen vormen.
Ons laboratorium onderzoekt hoe metabole communicatie tussen verschillende cellen in het beenmerg de werking van bloedstamcellen, de productie van bloedcellen en de groei van leukemie regelt. We gebruiken moderne technieken voor metabole analyse in combinatie met cel- en diermodellen om te onderzoeken hoe metabolieten die door één celtype worden geproduceerd, het gedrag van de andere cellen in hun omgeving beïnvloeden. Het doel van ons onderzoek is om metabole signalen te identificeren afkomstig van de niche die belangrijk zijn voor het behoud van bloedstamcellen en de productie van rode bloedcellen, witte bloedcellen en bloedplaatjes. Deze informatie kan vervolgens worden gebruikt om beenmergtransplantatie te verbeteren of om te helpen bij de behandeling van bloedziekten. Door de productie van normale en leukemie bloedcellen te vergelijken, willen we daarnaast veranderingen in metabole communicatiesystemen identificeren die het doelwit kunnen worden van behandelingen om de groei van leukemiecellen te verhinderen of de effectiviteit van huidige behandelmethoden zoals chemotherapie te verbeteren.
Bloedcelproductie bij volwassenen vindt plaats in het beenmerg, waar hematopoëtische stam- en voorlopercellen worden ondersteund door nichecellen die essentiële factoren produceren voor het onderhoud, de proliferatie en differentiatie van hematopoëtische cellen. De beenmergniche is complex en bestaat uit mesenchymale stromale cellen, osteoblasten, adipocyten, endotheelcellen, perivasculaire cellen, zenuwcellen en megakaryocyten, die zowel verschillende als overlappende functies vervullen bij hematopoëtische ondersteuning. De beenmergniche is ook betrokken bij de ontwikkeling en progressie van hematopoëtische aandoeningen zoals leukemie, waar competitie met gezonde stam- en voorlopercellen en hermodellering van de niche plaatsvindt.
Huidig onderzoek naar de beenmergniche is voornamelijk gericht op het identificeren van cellulaire bronnen van essentiële hematopoëtische cytokines zoals CXCL12, stem cell factor en trombopoietine. Deze ligand-receptor signaalroutes zijn echter gebouwd op evolutionair oude metabole communicatiemechanismen die niet goed gekend zijn. Ons doel is om het belang van metabole communicatie tussen verschillende celtypen in de beenmerg micro-omgeving te ontrafelen tijdens normale en abnormale bloedvorming. Gedetailleerde karakterisering van deze metabole interacties en hoe ze veranderen in de setting van ziekte kan nieuwe therapeutische kansen bieden voor hematologische aandoeningen, regeneratieve geneeskunde en kanker.
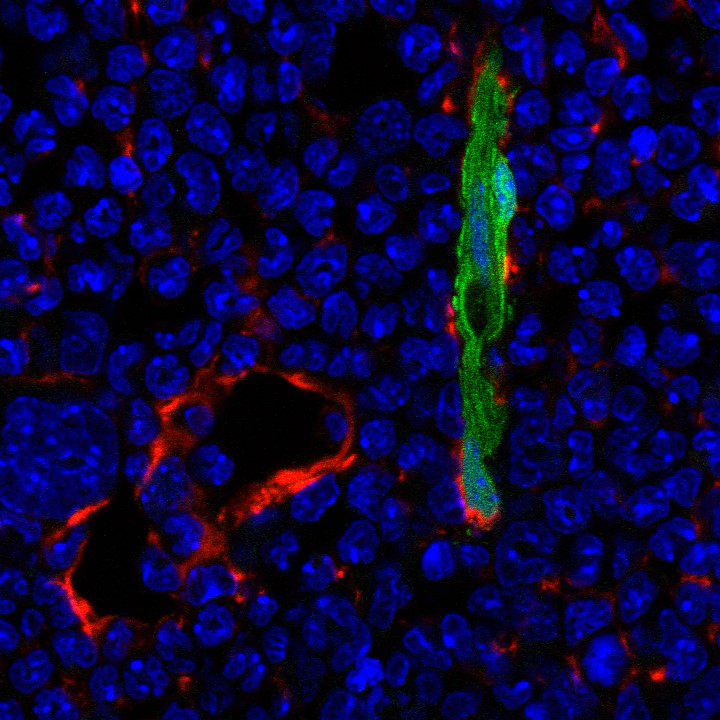
Immunohistochemische kleuring van muis beenmerg, met periarteriële cellen die Nestin tot expressie brengen (GFP, groen) en Leptin receptor-positieve stromale cellen (Cy3, rood). Celkernen werden gevisualiseerd met Hoechst (blauw).
PROJECTEN:
Stromale metabolieten in bloedvorming en leukemie
Aspartaat is een niet-essentieel aminozuur met diverse metabole functies in de cel. In ons eerdere onderzoek hebben we aangetoond hoe aspartaat geproduceerd door stromale beenmergcellen wordt gebruikt door acute myeloïde leukemiecellen om de productie van nucleotiden te voeden (van Gastel et al. Cell Metabolism 2020). In dit project willen we het belang van extracellulair aspartaat voor de groei van normale bloedcellen en leukemiecellen beter begrijpen en de identiteit van de aspartaat-producerende cellen in de beenmerg micro-omgeving onderzoeken. We zullen daarnaast ook andere metabole uitwisselingen tussen stromale en hematopoëtische cellen onderzoeken.
Rol van de micro-omgeving in resistentie tegen chemotherapie bij leukemie
Chemoresistentie is het verschil tussen remissie en genezing bij kankerpatiënten en is vooral duidelijk bij acute myeloïde leukemie, waar volledige remissies vaak voorkomen, maar slechts weinigen genezen. Ons doel is om te begrijpen hoe communicatie met andere cellen in de beenmergmicro-omgeving zeldzame leukemiecellen helpt overleven tijdens chemotherapiebehandeling, en hoe deze interacties het doelwit kunnen vormen van nieuwe therapieën om de overleving van patiënten te verbeteren.
Vetzuurwaarneming en metabolisme in leukemie
Vetzuren zijn belangrijke energiebronnen voor de voeding en essentiële structurele componenten van cellen. Hoe cellen de beschikbaarheid van vetzuren in hun directe omgeving waarnemen, blijft slecht begrepen. We hebben aangetoond dat FoxO-transcriptiefactoren een rol spelen bij de reactie op een tekort aan vetzuren (van Gastel et al. Nature 2020). Onze huidige inspanningen zijn gericht op het verder ontrafelen van de moleculaire structuur van dit mechanisme en het belang ervan voor de groei en overleving van cellen. Als onderdeel van dit onderzoek willen we ook begrijpen hoe het waarnemen van vetzuren en andere aspecten van het vetzuurmetabolisme ontregeld zijn bij leukemie.
Referenties
van Gastel N., Spinelli J.B., Sharda A., Schajnovitz A., Baryawno N., Rhee C., et al. Induction of a timed metabolic collapse to overcome cancer chemoresistance. Cell Metabolism 2020, 32 (3):391-403.
van Gastel N., Stegen S., Eelen G., Schoors S., Carlier A., Daniëls V.W., et al. Lipid availability determines fate of skeletal progenitor cells via SOX9. Nature 2020, 579 (7797):111-117.
