

Notre groupe étudie les communications réciproques épithélium:stroma qui orchestrent le développement de structures épithéliales dans le pancréas et la glande thyroïde, et les (dys)fonctions endocytaires dans la thyroïde et les reins.
Notre corps est composé de différents types de cellules, dont les cellules épithéliales qui remplissent des fonctions largement différentes : protection passive par la peau, défense active grâce aux lymphocytes, absorption de nutriments par l’épithélium intestinal, échange gazeux dans les alvéoles pulmonaires, sécrétion d’enzymes digestives par le pancréas, production d’hormones par la thyroïde… Et pourtant, au commencement, il n’y avait qu’une cellule, issue de la rencontre d’un spermatozoïde avec un ovule ! Durant le développement embryonnaire, cette cellule, dite totipotente, se divise de nombreuses fois pour donner naissance aux progéniteurs de tous les types cellulaire qui composent l’organisme adulte. Tout en continuant à proliférer, chaque type de progéniteurs s’organisent en une structure particulière (ex.: l’arbre bronchique) et se spécialisent progressivement dans l’acquisition d’une fonction précise (ex.: l’échange du dioxyde de carbone pour l’oxygène).
Le groupe du Pr C. Pierreux étudie le passage progressif des cellules épithéliales d’un état prolifératif vers un état spécialisé et organisé durant le développement embryonnaire du pancréas et de la thyroïde. Ces deux organes proviennent du tube digestif primitif, mais s’organisent : le premier en un réseau de canaux ramifiés spécialisé dans la sécrétion et le transport d’enzymes vers le duodénum (pour la digestion), le second en une collection de petits sacs clos pour la production interne d’hormones (vers le sang). Nous avons montré que, dans les deux cas, les cellules épithéliales forment d’abord un amas tridimensionnel non structuré par division rapide, puis se réorganisent en monocouches spécialisées et polarisées (Figure). Cette transition entre amas et monocouche est inversée durant les premières étapes de la transformation cancéreuse, comme si le film de la vie était montré à l’envers : ce concept que « l’oncogenèse réverse l’ontogenèse » (la genèse du cancer reproduit, en sens inverse, celle de l’individu) est le fil d’Ariane des recherches du Pr C. Pierreux.
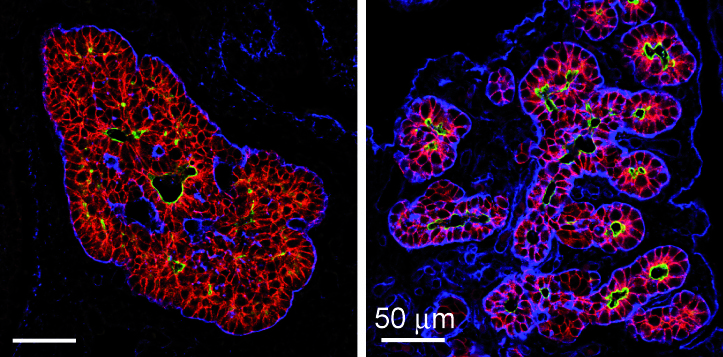
Légende :
Réorganisation épithéliale du bourgeon pancréatique. Durant l’embryogenèse précoce du pancréas, les cellules épithéliales (marquées en rouge) forment une masse multicellulaire avant de se réorganiser en monocouches polarisées avec un domaine apical distinct (marqué en vert) délimitant la lumière des canaux du pancréas. Les cellules épithéliales sont séparées de leur environnement par une lame basale (marquée en bleu) (de Hick et al., 2009).
Se diviser ou se spécialiser
Dans le pancréas et la thyroïde adulte, les cellules épithéliales ont cessé de se diviser et restent spécialisées dans leurs fonctions, sauf déclenchement du processus inverse responsable de la transformation en cancer. Les facteurs initiateurs qui déclenchent ce revirement à 180 degrés sont mal connus, car il est difficile de reconstituer après coup les premiers évènements quand le cancer est déjà établi. C’est pour contourner ce problème fondamental de l’oncogenèse que Christophe Pierreux a choisi d’analyser les processus décisifs de l’ontogenèse. Son expertise, combinée aux approches de biologie cellulaire du Pr P. Courtoy de l’unité CELL de l’Institut, a permis d’identifier un facteur-clé, capable à la fois d’allumer les gènes de la division et d’éteindre les gènes de la spécialisation. Ce «chef d’orchestre» est fortement exprimé dans les parties en expansion rapide des tissus embryonnaires, absent des tissus épithéliaux adultes et réapparaît dans certains cancers. Les études en cours visent à mieux comprendre ce qui (r)éveille ce facteur et comment il incite les cellules épithéliales à cesser de rendre leurs services et à se multiplier, jusqu’à se cancériser.
L’importance de l’environnement
La formation et le fonctionnement harmonieux d’organes aussi divers que le foie, les reins, le pancréas, les glandes mammaires ou la thyroïde, est le résultat de communications réciproques entre leurs trois composantes cellulaires principales. Les cellules épithéliales, dites « nobles », assurent les fonctions spécifiques de l’organe et sont organisées en monocouches. Les vaisseaux sanguins les nourrissent tout en leur envoyant des signaux. Les tissus interstitiels les soutiennent mais aussi les instruisent. Les signaux instructeurs échangés entre l’épithélium et son environnement (cellules endothéliales et mésenchymateuses) sont relayés jusqu’au noyau des cellules épithéliales par des protéines qui commandent aux gènes et reprogramment le devenir de la cellule : division, migration, spécialisation, changement de forme ou suicide. Les signaux échangés sont critiques pour la formation et l’homéostasie des organes épithéliaux, mais peuvent également être détournés ou utilisés à mauvais escient lors de la progression tumorale.
Communiquer dans l’intimité
Lorsqu’une tumeur atteint un volume critique, elle envoie des signaux pour attirer les vaisseaux sanguins. Ces vaisseaux détournent le sang des tissus sains pour soutenir la croissance de la tumeur, mais ils sont aussi la porte ouverte pour la dissémination des cellules tumorales dans le corps du patient et leur greffe à distance : les métastases potentiellement mortelles. Toujours en suivant le concept que « l’oncogenèse réverse l’ontogenèse » les recherches du groupe du Pr. C. Pierreux se concentrent également sur les interactions entre les cellules épithéliales (Figure en vert ci-contre) et les vaisseaux sanguins (en rouge) durant la formation du pancréas et de la thyroïde. Leur analyse fine révèle des interactions étroites et des échanges continus de signaux, tant dans le pancréas que dans la thyroïde. Comprendre ce langage et son décodage intracellulaire sert l’embryologie, mais également la médecine par l’identification de biomarqueurs ou le développement d’outils thérapeutiques.
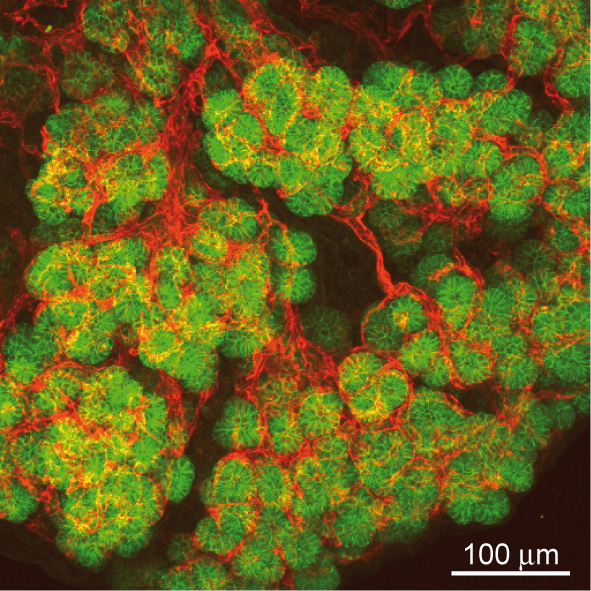
Légende :
Contact intime entre l’épithelium et l’endothelium dans le pancréas. Projections de 40 images confocales obtenues sur une épaisseur de 40 micromètres de tissus pancréatique. Les cellules endothéliales (en rouge) montrent une association intime avec les cellules épithéliales du pancréas embryonnaire (en vert).
Un exemple de communication intercellulaire présenté par Ophélie Delcorte, étudiante en thèse.
Epithelial parenchyma form during embryogenesis as polarized monolayers and acquire their characteristic differentiation by interplay of intrinsic transcriptional regulation and key extrinsic signals from the instructing stroma. At the subcellular level, stabilization of polarity is also linked to endocytic trafficking. In the adult, apical endocytosis and lysosomal processing are essential for kidney and thyroid function. Research aims at (1) delineating the signals and effects of epithelial:stromal reciprocal interactions in the control of epithelial organogenesis in mouse embryos, and (2) better understanding the role of apical endocytosis in epithelial homeostasis and disease.
Epithelial organogenesis and differentiation
We focus on epithelial-endothelial communications during the development of two endoderm-derived organs, the pancreas and the thyroid. For these two organs, we developed unique 3D culture systems and we routinely exploit leading-edge microscopy on explant cultures as well as on genetically engineered tissues (movie). By combining these in vivo and ex vivo models and tools, we want to address the following questions: which signals drive epithelial morphogenesis towards a branched network of open ducts (exocrine pancreas) or towards independent closed follicles (thyroid)? How does the epithelium recruit blood vessels and how do the recruited endothelial cells instruct the epithelial cells?
Movie: Close association of epithelial cells with endothelial in the developing thyroid. In-depth topological relations between thyrocyte progenitors (nuclei in green) and endothelial cells (in red) in ex vivo cultured thyroid, analysed by multiphotons microscopy. The movie shows a succession of 60 confocal images taken every micrometer.
We have shown that during pancreatic organogenesis, progenitors first form a proliferating 3D mass of non-polarized epithelial cells that then reorganize into a specialized monolayer. This epithelial transition from a mass to a monolayer requires a coordinate and dynamic interaction with their environment, composed of mesenchymal and endothelial cells. We identified SDF-1 (Stromal cell-Derived Factor-1) as an important signal, produced by the mesenchymal cells, for the reorganization of the pancreatic and salivary epithelial masses into monolayers (Hick et al., 2009). (Figure)

Figure: Branching morphogenesis in the pancreas. Reorganization in the early pancreatic bud of the multicellular mass of epithelial cells labelled for E-cadherin (left, red) into polarized monolayers with distinct apical domains (mucin, green) and their merging to create tubules (right). Laminin (blue) delineates basement membranes (From Hick et al., 2009).
Three-dimensional analysis of the developing pancreas by multiphoton microscopy uncovered a dense and close association of the epithelium with endothelial cells (Figure vessels). Our in vivo and in vitro data show that endothelial cell recruitment depends on VEGF production by the pancreatic epithelium. Interestingly, localized VEGF expression in the epithelial trunk cells is critical to recruit endothelial cells around the trunk, at a distance from the tip cells. We further show that endothelial cells, in turn, focally restrict acinar differentiation (Pierreux et al., 2010).

Figure: Epithelial - endothelial interactions in the pancreas. Projections of 40 confocal images showing the dense and close association of pancreatic epithelial cells, labelled for E-cadherin (green), with endothelial cells, labelled for PECAM (red), in the embryonic pancreas.
These data demonstrate that paracrine epithelial:mesenchyme and epithelial:endothelial communications are crucial for pancreas development. Our studies on pancreatic epithelial morphogenesis and on the role of endothelial cells were followed and confirmed by others (Villasenor, 2010; Sand, 2011; Magenheim, 2011).
Recently, we also investigated the role of endothelial cells during thyroid development. In contrast to the pancreas, all thyroid progenitors express VEGF and its level of expression is the highest in e14.5 embryos (Figure Vegfa-ISH). Thyroid-specific Vegfa inactivation reveals that VEGF is required for endothelial cell recruitment at the time of epithelial folliculogenesis. In the absence of blood vessels, thyrocytes progenitors do not organize in large follicles: small lumens are visible but these are shared by few cells or are found intracellularly (Figure ME). Using an ex vivo thyroid culture system, we confirmed the follicular defect and demonstrated that culture medium conditioned by endothelial progenitor cells can rescue and stimulate follicle formation (Hick et al., 2013).
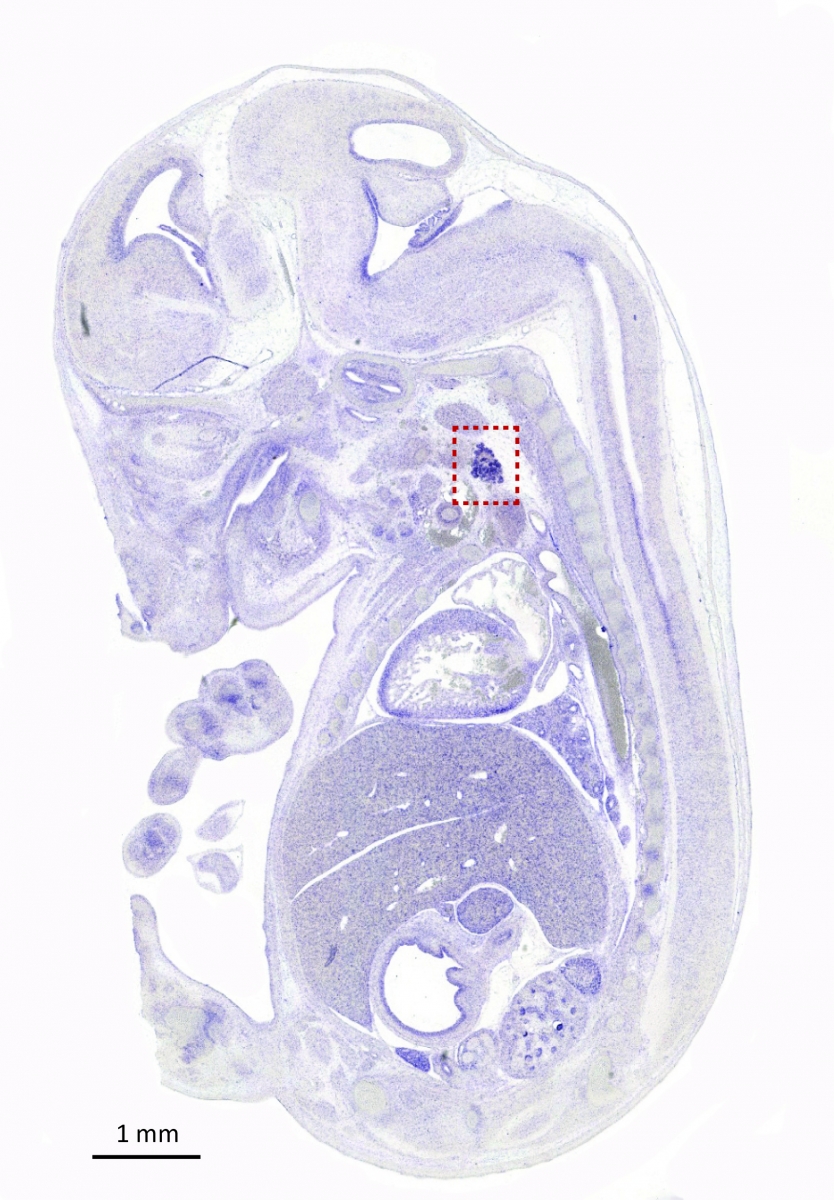
Figure: Vegfa is highly expressed in the thyroid. In situ hybridization with a Vegfa antisense probe show strong staining of the thyroid bud in e14.5 embryo (sagittal section). Thyroid region is boxed (From Hick et al., 2013).
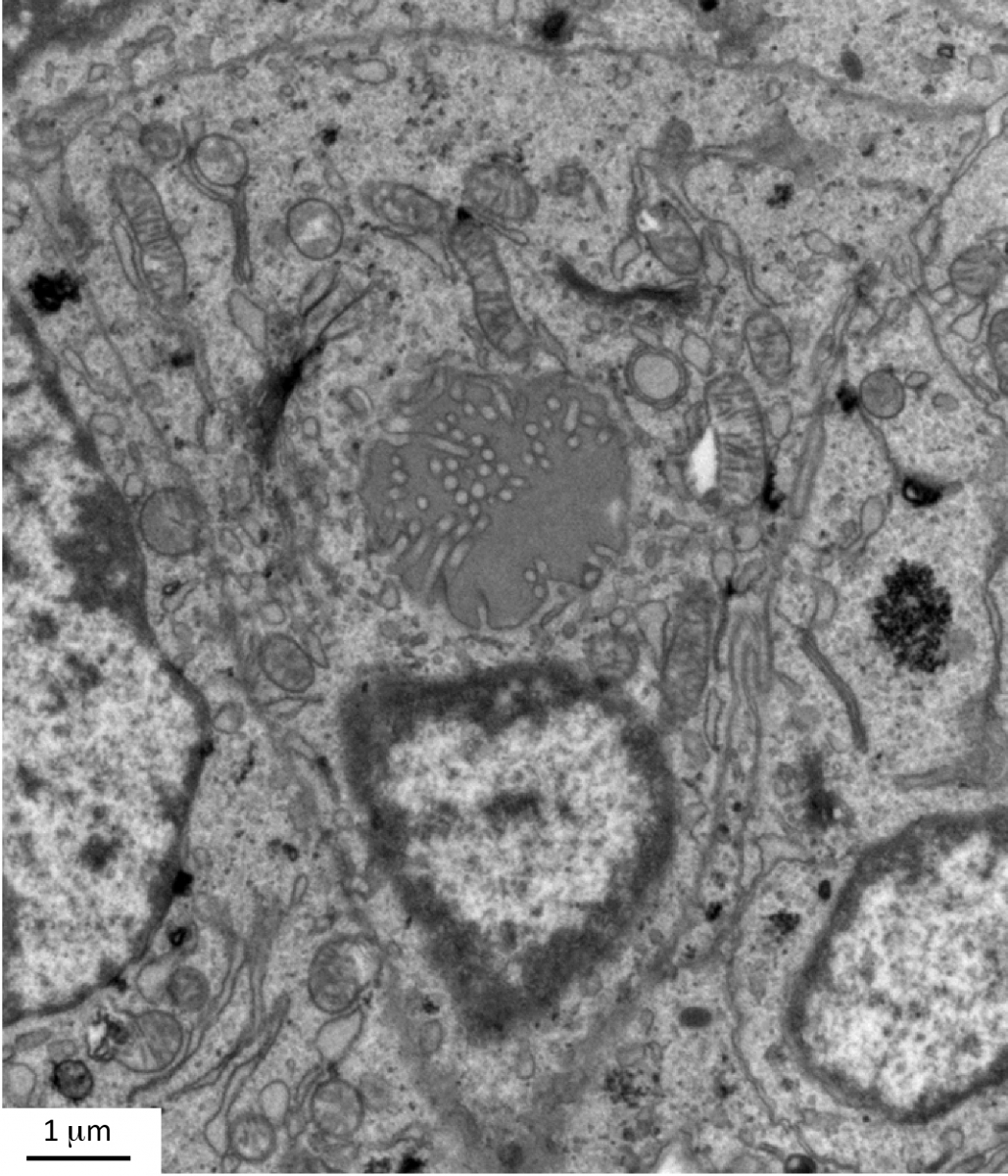
Figure: Defective lumen formation in Vegfa conditional knockout. Electron microscopy of Vegfa conditional knockout thyroid showing a thyrocyte progenitor containing an intracellular lumen with membranous projections (From Hick et al., 2013).
Current work focuses on the network of reciprocal juxtacrine communications between epithelial cells and blood vessels, on their intracellular decoding by epithelial transcription factors during mouse development, and on their implications during human carcinogenesis.
Epithelial homeostasis and apical endocytosis diseases
We focus on two organs with most active apical endocytosis, the kidneys and the thyroid. Due to extraordinary efficiency of apical receptor-mediated endocytosis, kidney proximal tubular cells (PTCs) are a unique system to study machineries of apical endocytic trafficking and their involvement in kidney diseases. Using KO mice for the chloride channel, ClC-5, as model of Dent’s disease (familial predisposition to kidney stones), we found that this channel is essential for apical endocytic recycling (Christensen et al, 2003). Using similar systems, we demonstrated that circulating lysosomal enzymes are continuously filtered in glomeruli, reabsorbed by megalin-mediated endocytosis, and transferred into lysosomes to exert their function, thus providing a major source of enzymes to PTCs. These observations extend the significance of megalin in PTCs and have several physiopathological and clinical implications (Nielsen et al, 2005).
Recently, we identified a key role of class III PI3-kinase/VPS34 in apical recycling of endocytic receptors. In vitro, VPS34 inhibition with LY294002 induced selective apical endosome swelling and sequestration of the endocytic receptor, megalin. This effect was reversible: removal of the inhibitor induced a spectacular burst of recycling tubules and restored the megalin surface pool (Fig. 3). In mouse pups PTCs, conditional Vps34 inactivation also led to vacuolation and intracellular megalin redistribution. We anticipate that these KO mice and reversible PI3K inhibition will help further identify rate-limiting actors of apical endocytosis, of both fundamental and clinical importance (Carpentier et al, 2013).
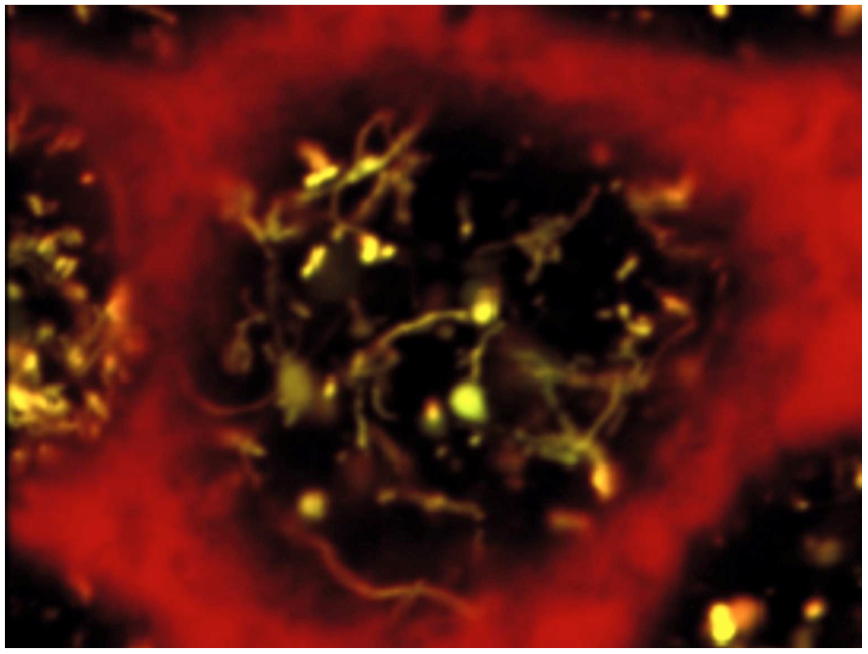
Figure: Reversible PI3K inhibition as a tool to synchronize apical endocytic recycling. Apical endosomes of polarized PTCs were loaded by endocytosis of fluorescent tracers, then PI3K was inhibited by LY294002 to induce endosome vacuolation. PI3K restoration by LY294002 chase reverses vacuolation and triggers a spectacular burst of recycling tubules (From Carpentier et al, 2013).
Current investigations are also addressing the pathophysiology of cystinosis, a multisystemic lysosomal disease due to defective lysosomal membrane cystine/H+ antiporter, cystinosin. This disease first manifests itself in kidney as a generalized PTC dysfunction, referred to as kidney Fanconi syndrome. Endocytosis of ultrafiltrated plasma proteins rich in disulfide bridge rich must be the main source of lysosomal cystine in PTCs. Current analysis of cystinosin KO mice helps us understanding how cystine accumulation causes apical PTC lysosomal overload linked to dedifferentiation, prior to huge cystine crystals and eventual atrophy (Fig. 4). We identified three adaptation mechanisms: vesicular efflux of soluble cystine, lysosomal cysteine crystal discharge, and apoptotic shedding with proliferative epithelial repair (Gaide-Chevronnay et al, 2014). In cystinotic thyroid, defective lysosomal generation of thyroid hormones from thyroglobulin induces a strong TSH response causing thyrocyte hypertrophy and hyperplasia. In collaboration with S. Cherqui (UCSD, CA), we demonstrated that cystinotic thyroid lesions could be fully prevented by grafting hematopoietic stem cells and currently decipher the correction of epithelial defects in kidneys and thyroid across their basal lamina.
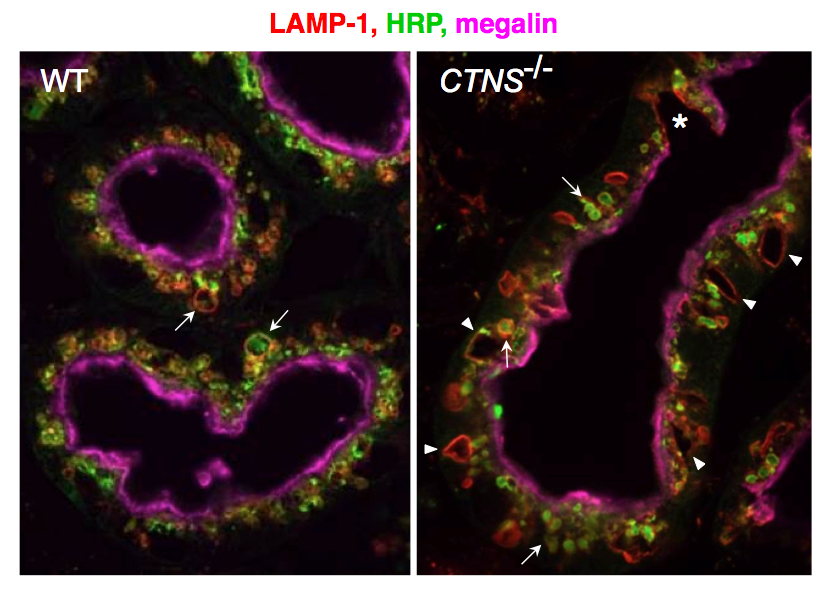
Figure: Progression of PTC lesions in cystinosin KO mice. At 6 months (a), only PTCs immediately following glomeruli (overlaid in pale green) show extensive apical vacuolation (arrows), indicating osmotic swelling of lysosomes by accumulating cystine, contrasting with integrity of kidney elsewhere, including more distal PTCs. (b) At 12 months, proximal PTCS are now completely atrophic (arrowheads) and more distal PTCs harbour numerous crystals (appearing as empty spaces with characteristic geometric shape; red triangles).
Steed E, Elbediwy A, Vacca B, Dupasquier S, Hemkemeyer SA, Suddason T, Costa AC, Beaudry JB, Zihni C, Gallagher E, Pierreux CE, Balda MS, Matter K.
J Cell Biol. 2014; 204(5):821-38.
Hick AC, Delmarcelle AS, Bouquet M, Klotz S, Copetti T, Forez C, Van Der Smissen P, Sonveaux P, Collet JF, Feron O, Courtoy PJ, Pierreux CE.
Dev Biol. 2013; 381(1):227-40.
Carpentier S, N'Kuli F, Grieco G, Van Der Smissen P, Janssens V, Emonard H, Bilanges B, Vanhaesebroeck B, Gaide Chevronnay HP, Pierreux CE, Tyteca D, Courtoy PJ.
Traffic. 2013; 14(8):933-48.
Pierreux CE, Cordi S, Hick AC, Achouri Y, Ruiz de Almodovar C, Prévot PP, Courtoy PJ, Carmeliet P, Lemaigre FP.
Dev Biol. 2010; 347(1):216-27.
Lima WR, Parreira KS, Devuyst O, Caplanusi A, N'kuli F, Marien B, Van Der Smissen P, Alves PM, Verroust P, Christensen EI, Terzi F, Matter K, Balda MS, Pierreux CE, Courtoy PJ.
J Am Soc Nephrol. 2010; 21(3):478-88.
Hick AC, van Eyll JM, Cordi S, Forez C, Passante L, Kohara H, Nagasawa T, Vanderhaeghen P, Courtoy PJ, Rousseau GG, Lemaigre FP, Pierreux CE.
BMC Dev Biol. 2009; 9:66.
Pierreux CE, Poll AV, Kemp CR, Clotman F, Maestro MA, Cordi S, Ferrer J, Leyns L, Rousseau GG, Lemaigre FP.
Gastroenterology. 2006; 130(2):532-41.
Poll AV, Pierreux CE, Lokmane L, Haumaitre C, Achouri Y, Jacquemin P, Rousseau GG, Cereghini S, Lemaigre FP.
Diabetes. 2006; 55(1):61-9.
Clotman F, Jacquemin P, Plumb-Rudewiez N, Pierreux CE, Van der Smissen P, Dietz HC, Courtoy PJ, Rousseau GG, Lemaigre FP.
Genes Dev. 2005; 19(16):1849-54.
Pierreux CE, Vanhorenbeeck V, Jacquemin P, Lemaigre FP, Rousseau GG.
J Biol Chem. 2004; 279(49):51298-304.
van Eyll JM, Pierreux CE, Lemaigre FP, Rousseau GG.
J Cell Sci. 2004; 117(Pt 10):2077-86.
Pierreux CE, Nicolás FJ, Hill CS.
Mol Cell Biol. 2000; 20(23):9041-54.
Lehmann K, Janda E, Pierreux CE, Rytömaa M, Schulze A, McMahon M, Hill CS, Beug H, Downward J.
Genes Dev. 2000; 14(20):2610-22.

DIFFERENCIATION, ENDOCYTOSE ET HOMEOSTASIE EPITHELIALE