

La conversion des nutriments de l'environnement en énergie et en biomasse est un défi fondamental de la vie. Les organismes unicellulaires, comme les bactéries ou les levures, font face à ce défi dans chaque cellule individuellement. Néanmoins, en traitant les nutriments, dont la disponibilité est fluctuante, ils produisent des métabolites qui fonctionnent comme des signaux de communication pour s'adapter au stress environnemental ou coordonner la croissance. Un avantage important de la multicellularité est la capacité des cellules à se diversifier métaboliquement et à travailler ensemble, les métabolites produits dans un type de cellule étant utilisés comme nutriments par un autre. Dans les organismes complexes tels que les mammifères, les métabolites sont également utilisés pour la communication cellulaire, mais l'étendue et l'importance de ces interactions ne sont pas bien comprises.
Un exemple de tissu dans lequel différents types de cellules travaillent ensemble est la moelle osseuse, où sont produits quotidiennement 200 milliards de globules rouges, 10 milliards de globules blancs et 400 milliards de plaquettes sanguines. Le bon fonctionnement de ce système repose non seulement sur les cellules souches sanguines, mais également sur leurs interactions avec d'autres types de cellules du microenvironnement de la moelle osseuse: les cellules osseuses, les cellules des vaisseaux sanguins, les cellules immunitaires et les cellules du tissu conjonctif, communément désignées comme la niche de la moelle osseuse. La niche de la moelle osseuse est également impliquée dans le développement et la progression de tumeurs malignes du sang, telles que la leucémie, dans lesquelles les cellules souches sanguines commencent à se développer de manière incontrôlable et ne forment plus des cellules sanguines normales.
Notre laboratoire explore la façon dont la communication métabolique entre différentes cellules de la moelle osseuse a un impact sur la fonction des cellules souches sanguines, la production de cellules sanguines et la croissance de la leucémie. Nous utilisons des techniques d'analyse métabolique modernes en combinaison avec des modèles cellulaires et animaux pour étudier comment les métabolites produits par un type cellulaire influencent le comportement des autres cellules dans son environnement. L'objectif de notre recherche est d'identifier les signaux métaboliques importants dérivés de niche pour le maintien des cellules souches sanguines et la production de globules rouges, de globules blancs et de plaquettes sanguines. Ces informations peuvent ensuite être utilisées pour améliorer la transplantation de moelle osseuse ou aider au traitement des maladies hématologiques.
En comparant la production de cellules sanguines normales et leucémiques, nous visons aussi à identifier les changements dans les systèmes de communication métabolique qui peuvent être ciblés pour réduire la croissance des cellules leucémiques ou améliorer l'efficacité des méthodes de traitement actuelles telles que la chimiothérapie.
Blood cell production in adults occurs in the bone marrow, where hematopoietic stem and progenitor cells are supported by niche cells that provide essential factors for hematopoietic cell maintenance, proliferation and differentiation. The bone marrow niche is complex, consisting of mesenchymal stromal cells, osteolineage cells, adipocytes, endothelial cells, perivascular cells, nerve cells and megakaryocytes, which perform both distinct and overlapping functions in hematopoietic support. The bone marrow niche is also involved in the development and progression of hematopoietic malignancies such as leukemia, where competition with healthy stem and progenitor cells and niche remodeling occurs.
Research into the bone marrow niche has focused primarily on identifying cellular sources of essential hematopoietic cytokines such as CXCL12, stem cell factor and thrombopoietin. However, these ligand-receptor signaling pathways are layered upon more evolutionary ancient metabolic communication mechanisms that are poorly understood. Our goal is to unravel the importance of metabolic crosstalk between different cell types in the bone marrow microenvironment for normal and malignant hematopoiesis. Detailed characterization of these metabolic interactions, and how they are altered in the setting of disease, can provide new therapeutic opportunities for hematological disorders, regenerative medicine and cancer.
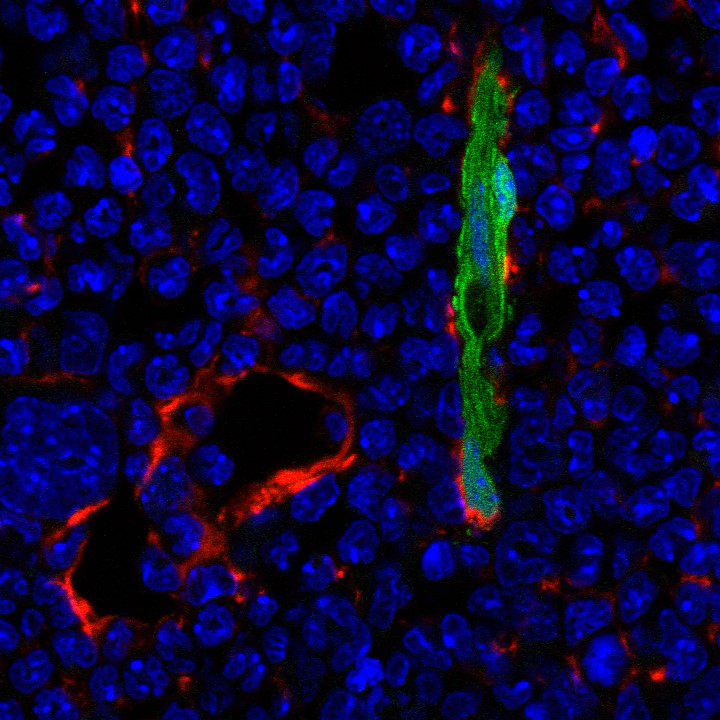
Immunohistochemical staining showing Nestin-expressing periarterial cells (GFP, green) and Leptin Receptor-positive stromal cells (Cy3, red) in the mouse bone marrow microenvironment. Cell nuclei are visualized using Hoechst (blue).
PROJECTS:
Stromal metabolites in hematopoiesis and leukemia
Aspartate is a non-essential amino acid with diverse metabolic functions in the cell. In our previous research, we showed how aspartate produced by bone marrow stromal cells is used by acute myeloid leukemia cells to fuel nucleotide production (van Gastel et al. Cell Metabolism 2020). In this project, we aim to understand the importance of extracellular aspartate for normal hematopoietic and leukemia cell growth, and investigate the identity of the aspartate-secreting cells in the bone marrow microenvironment. We will also explore additional metabolic exchanges between stromal and hematopoietic cells.
Microenvironmental contributions to chemotherapy resistance in leukemia
Chemoresistance is the difference between remission and cure in cancer patients and is particularly evident in acute myeloid leukemia, where complete remissions are common, but few are cured. Our goal is to understand how communication with other cells in the bone marrow microenvironment helps rare leukemia cells persist during chemotherapy treatment, and how these interactions can be therapeutically targeted to improve patient survival.
Fatty acid sensing and metabolism in leukemia
Fatty acids are important dietary fuel sources and essential structural components of cells. How cells sense the availability of fatty acids in their direct environment remains poorly understood. We have shown that FoxO transcription factors play a role in the response to fatty acid deprivation (van Gastel et al. Nature 2020). Current efforts are focused on further unraveling the molecular structure of this mechanism and its importance for cell growth and survival. As part of this research, we also aim to understand how fatty acid sensing and other aspects of fatty acid metabolism are dysregulated in the setting of leukemia.
References
van Gastel N., Spinelli J.B., Sharda A., Schajnovitz A., Baryawno N., Rhee C., et al. Induction of a timed metabolic collapse to overcome cancer chemoresistance. Cell Metabolism 2020, 32 (3):391-403.
van Gastel N., Stegen S., Eelen G., Schoors S., Carlier A., Daniëls V.W., et al. Lipid availability determines fate of skeletal progenitor cells via SOX9. Nature 2020, 579 (7797):111-117.
