

Nous identifions les gènes qui contrôlent la différenciation des cellules du foie et du pancréas et nous déterminons ensuite comment le dysfonctionnement de ces gènes est à l'origine de pathologies, et comment ces dernières peuvent être traitées en restaurant la fonction des cellules et des gènes.
La structure et la fonction des cellules diffèrent d'un organe à l'autre, et le processus par lequel les cellules acquièrent leurs propriétés spécifiques au cours de la vie embryonnaire est qualifié de "différenciation cellulaire". Par l'étude de souris transgéniques et d'échantillons prélevés chez des patients, nous avons identifié des gènes essentiels pour la différenciation des cellules du foie et du pancréas. En parallèle, nous avons découvert que le dysfonctionnement de ces gènes est associé à des pathologies telles que les malformations congénitales et le cancer.

Les hépatoblastes sont les cellules qui constituent le foie chez le foetus. Ils donnent progressivement naissance aux hépatocytes qui exercent les fonctions métaboliques du foie chez l'adulte, ou aux cholangiocytes qui délimitent les canaux biliaires. Nous avons découvert des gènes qui déterminent comment un hépatoblaste se différencie en hépatocyte ou en cholangiocyte, et nous étudions comment le dysfonctionnement de ces gènes influence certaines maladies. Premièrement, dans certaines formes de cancer du foie, les hépatocytes sont convertis en cholangiocytes cancéreux, et nous étudions le rôle de gènes de la différenciation dans ce processus. Deuxièmement, certaines anomalies métaboliques pourraient être traitées par implantations d'hépatocytes produits in vitro. Nous collaborons avec d'autres équipes pour optimiser la production de cellules hépatiques, et nous contribuons dans ce travail par notre savoir-faire en matière de différenciation cellulaire.
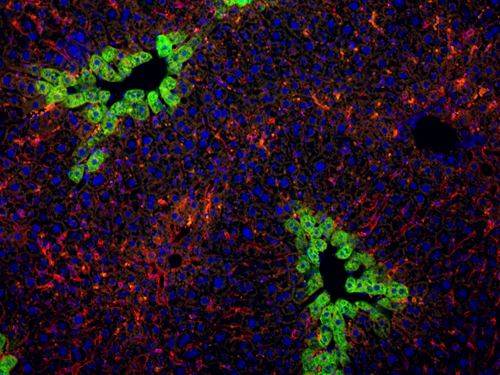
Nous avons également identifié des gènes critiques pour la différenciation des cellules progénitrices du pancréas en cellules endocrines, acinaires et canalaires. Les cellules endocrines et acinaires sont respectivement responsables de la production d'hormones (par exemple l'insuline) et des sucs digestifs. Les cellules canalaires délimitent les canaux pancréatiques par où s'écoulent les sucs digestifs. De manière similaire au cancer du foie, le cancer du pancréas est initié par des anomalies de la différenciation des cellules. Nous étudions comment les gènes de la différenciation influencent le développement du cancer du pancréas et déterminons quelles cellules (acinaires et/ou canalaires) sont à l'origine des tumeurs. La compréhension du développement des cancers du foie et du pancréas devrait permettre de diagnostiquer ces maladies plus tôt et donc de prendre en charge les patients plus efficacement et à un stade plus précoce de la maladie.
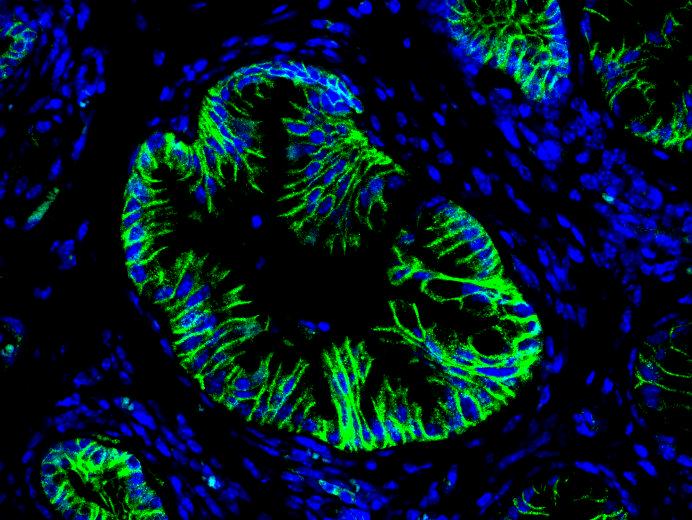
Hepatic cell differentiation
In the embryo, liver progenitor cells (hepatoblasts) derive from the endoderm, the cell layer that delineates the primitive gut. The classical model of liver development predicts that hepatoblasts give rise to hepatocyte precursors, which mature to hepatocytes, and to "ductal plate cells", which generate the cholangiocytes and form bile ducts. Using trangenic mouse models, we have updated the fate map of the hepatic cells in the embryo: the ductal plate cells generate cholangiocytes and bile ducts, but also a subset of hepatocytes, as well as the adult liver stem cells. We now investigate the mechanisms that control acquisition and maintenance of liver cell differentiation in health and disease.
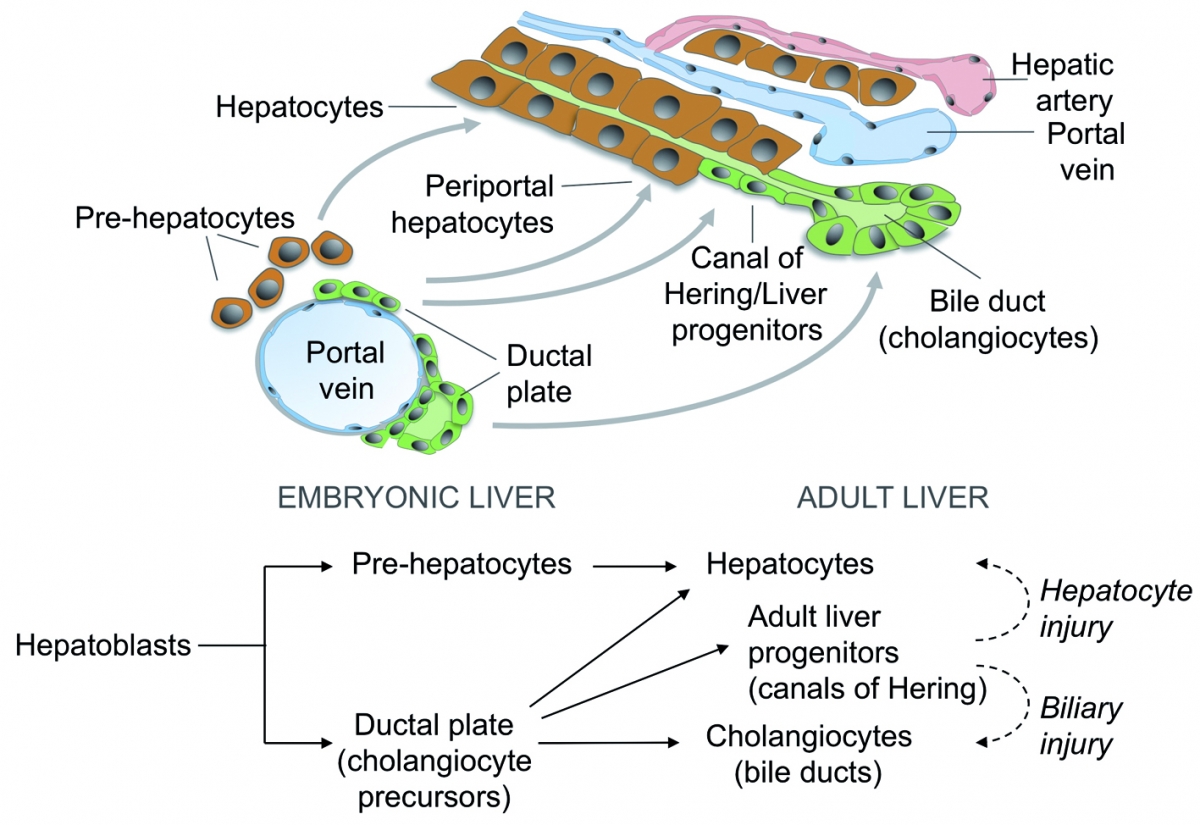
Legend
During development, liver progenitor cells called hepatoblasts give rise to hepatocyte and cholangiocyte precursors. These cells then mature to generate adult hepatocytes forming cords and cholangiocytes delineating bile ducts. Part of the cholangiocyte precursors revert to a hepatocyte phenotype or give rise to adult liver progenitor cells.
Our discovery of the Onecut transcription factors Onecut-1 (OC-1/HNF-6), OC-2 and OC-3, and the subsequent phenotypic characterization of HNF-6 and OC-2 knockout mice led to the identification of transcriptional and signaling networks regulating liver development. We also found that bile duct development proceeds according to a unique process characterized by transient asymmetry. Current efforts are devoted to the characterization of the mechanisms driving three-dimensional morphogenesis of the bile ducts and hepatocyte cords
In collaboration with clinical centers, we investigate how the knowledge gained from our fundamental studies can be translated in the understanding of the pathophysiology of human biliary diseases, including cholangiocarcinoma. In this context we specifically focus on molecular mechanisms driving formation of precancerous lesions and their progression towards invasive tumor using experimental models that faithfully recapitulate human tumorigenesis.
Pancreatic cell differentiation
Our research on the role of the Onecut transcription factor OC-1/HNF-6 uncovered that this protein is required for development of pancreatic endocrine cells and pancreatic ducts. In the absence of HNF6, endocrine cells fail to develop in the embryo and ducts form cysts. Subsequent research identified transcription-factor microRNA networks in pancreatic cell differentiation; perturbation of these networks causes pancreatic acinar cells to undergo acinar-to-ductal metaplasia, a precursor lesion of pancreatic cancer. Using our extensive expertise in the generation and phenotyping of transgenic mice, we also uncovered that pancreatic duct cells can be at the origin of intraductal papillary mucinous neoplasms, another frequent precursor lesion of pancreatic cancer
Current work is focused on the role of gene regulatory networks, oncogenes and signaling pathways in development of pancreatic adenocarcinoma. Specfic attention is paid to the mode of action of the Kras oncogene and on the role of primary cilia.
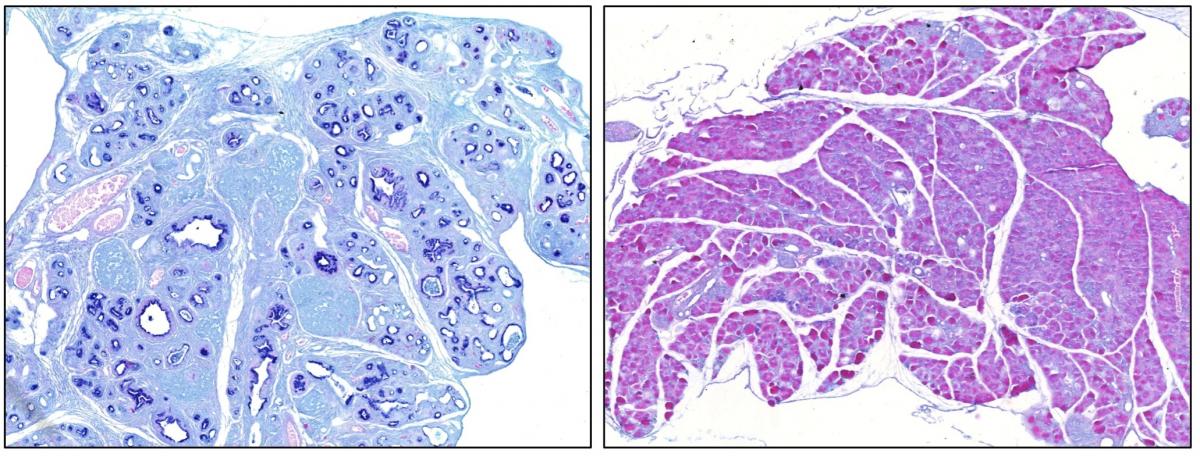
Legend
Alcian Blue staining of section of a pancreas expressing the oncogene Kras (left) and of a pancreas expressing the oncogene Kras in the absence of the transcription factor Sox9 (right). Dark blue staining identifies preneoplastic lesions whereas no such lesions are seen in the absence of Sox9. This result reveals that Sox9 is essential for the initiation of pancreatic ductal adenocarcinoma.
Hepatology. 2021; 74(3):1445-1460.
Cancer Res. 2021; 81(10):2679-2689.
Gut. 2020; 69(4):704-14.
J Hepatol. 2019; 71(2):323-32.
Annu Rev Pathol. 2020; 15:1-22.
J Hepatol. 2018; 68(5):1049-62.
Hepatology. 2018; 67(1):313-27.
Hum Mol Genet. 2016; 25(22):5017-26.
Dev Biol. 2015; 404(2):136-48.
Grimont A, Pinho AV, Cowley MJ, Augereau C, Mawson A, Giry-Laterrière M, Van den Steen G, Waddell N, Pajic M, Sempoux C, Wu J, Grimmond SM, Biankin AV, Lemaigre FP, Rooman I, Jacquemin P
Gut. 2014; 64(11):1790-9.
Prévot PP, Augereau C, Simion A, Van den Steen G, Dauguet N, Lemaigre FP, Jacquemin P.
Gastroenterology. 2013; 145(3):668-78.e3.
Español-Suñer R, Carpentier R, Van Hul N, Legry V, Achouri Y, Cordi S, Jacquemin P, Lemaigre F, Leclercq IA.
Gastroenterology. 2012; 143(6):1564-75.e7.
Prévot PP, Simion A, Grimont A, Colletti M, Khalaileh A, Van den Steen G, Sempoux C, Xu X, Roelants V, Hald J, Bertrand L, Heimberg H, Konieczny SF, Dor Y, Lemaigre FP, Jacquemin P.
Gut. 2012; 61(12):1723-32.
Antoniou A, Raynaud P, Cordi S, Zong Y, Tronche F, Stanger BZ, Jacquemin P, Pierreux CE, Clotman F, Lemaigre FP.
Gastroenterology. 2009; 136(7):2325-33.
Clotman F, Jacquemin P, Plumb-Rudewiez N, Pierreux CE, Van der Smissen P, Dietz HC, Courtoy PJ, Rousseau GG, Lemaigre FP.
Genes Dev. 2005; 19(16):1849-54.
Clotman F, Lannoy VJ, Reber M, Cereghini S, Cassiman D, Jacquemin P, Roskams T, Rousseau GG, Lemaigre FP.
Development. 2002; 129(8):1819-28.
Jacquemin P, Durviaux SM, Jensen J, Godfraind C, Gradwohl G, Guillemot F, Madsen OD, Carmeliet P, Dewerchin M, Collen D, Rousseau GG, Lemaigre FP.
Mol Cell Biol. 2000; 20(12):4445-54.
Lemaigre FP, Durviaux SM, Truong O, Lannoy VJ, Hsuan JJ, Rousseau GG.
Proc Natl Acad Sci USA. 1996; 93(18):9460-4.

ACQUISITION ET PERTE DE L'IDENTITE CELLULAIRE DANS LE FOIE ET LE PANCREAS