

Des réactions immunitaires excessives peuvent détruire des tissus sains et causer des maladies auto-immunitaires. Les Lymphocytes T régulateurs, ou Tregs, sont des cellules sanguines qui nous protègent contre ces maladies en inhibant les réponses immunitaires inappropriées. Cependant, les Tregs peuvent aussi inhiber des réponses immunes souhaitables et jouer un rôle délétère, chez les patients cancéreux par exemple. Notre équipe cherche à identifier les mécanismes par lesquels les Tregs suppriment les réponses immunes. Notre objectif à long terme est de développer de nouvelles stratégies thérapeutiques qui permettent de modifier l’activité des Tregs chez les patients qui souffrent de cancer ou de maladies auto-immunitaires.
Que sont les Lymphocytes T régulateurs, ou Tregs ?
Le système immunitaire protège les organismes contre les infections par des microbes. Chez les mammifères, et donc chez l’homme, le système immunitaire est constitué des globules blancs, qui circulent dans le corps et scrutent les cellules et les tissus à la recherche d’anomalies caractéristiques d’une infection. La rencontre entre des cellules immunitaires et des cellules infectées mène généralement à la destruction des cellules infectées, et à l’éradication du microbe. Cependant, la machinerie de destruction dont disposent les cellules immunitaires leur confère la capacité de tuer aussi des cellules normales, non infectées, et de provoquer des dégâts pathologiques dans des tissus par ailleurs parfaitement sains. Plusieurs mécanismes de contrôle existent pour prévenir la destruction des tissus sains par le système immunitaire. Parmi ceux-ci, une catégorie de globules blancs très spéciaux joue un rôle prépondérant. On les appelle les Lymphocytes T Régulateurs, ou Tregs. Les Tregs sont spécialisés dans la régulation des réponses immunes et préviennent la survenue de maladies auto-immunitaires.
Quelles maladies sont causées ou favorisées par un dysfonctionnement des Tregs ?
Les patients atteints d’une maladie génétique appelée « IPEX » n’ont pas de Treg. Leur système immunitaire, laissé sans surveillance, devient hyper réactif et attaque de nombreux tissus. L’IPEX se manifeste par un syndrome auto-immunitaire très sévère, caractérisé par une combinaison de symptômes dus à l’atteinte de multiples organes. Heureusement, les mutations génétiques responsables de l’absence de Tregs et de l’IPEX sont très rares dans les populations humaines. Plus fréquentes sont les maladies auto-immunitaires qui affectent un seul, ou un nombre limité d’organes. Ces maladies comprennent la maladie de Crohn, la recto-colite ulcéro-hémorragique, le diabète de type I, la sclérose en plaque et d’autres encore. Bien que les Tregs soient présents chez les patients atteints de ces maladies, leurs fonctions immuno-suppressives sont diminuées, ce qui semble contribuer au développement de la pathologie. Une insuffisance de la fonction des Tregs est également impliquée dans les rejets de greffe d’organe, aussi causés par des réactions immunitaires non désirées et excessives. Une forme particulière correspond à la maladie du greffon contre l’hôte, que l’on observe chez des patients ayant reçu une greffe de moelle osseuse pour traiter une leucémie ou une autre affection hématologique. Elle est causée par l’attaque des organes de l’hôte par des cellules immunitaires du donneur. Il semblerait qu’une activité plus intense des Tregs pourrait prévenir ou atténuer ces maladies de rejet.
Si une insuffisance de fonction des Tregs favorise les maladies auto-immunitaires ou les complications des greffes, un excès de fonction peut aussi se révéler délétère, et contribuer au développement de maladies qui pourraient être contrôlées par des réponses immunitaires efficaces. Notre équipe s’intéresse tout particulièrement aux cancers. En effet, notre système immunitaire est capable de reconnaître les cellules tumorales et de les détruire comme s’il s’agissait de cellules infectées. Lorsqu’un cancer devient détectable chez un patient, c’est en partie parce que son système immunitaire n’a pas été capable de contrôler la croissance tumorale. Les Tregs semblent inhiber les réponses immunes anti-tumorales, et favorisent ainsi la progression des cancers. Les infections chroniques, responsables de maladies comme le SIDA ou certaines hépatites, seraient également favorisées par un excès de fonction des Tregs.
Comment les Tregs suppriment-ils les réponses immunitaires ?
Un dysfonctionnement des Tregs favorise de nombreuses maladies. Raison pour laquelle il est important de comprendre comment ces cellules fonctionnent. L’élucidation des mécanismes immuno-suppresseurs des Tregs devrait permettre de développer de nouvelles approches thérapeutiques qui améliorent ou diminuent leur activité, en fonction du type de maladie à soigner. De nombreuses études chez la souris indiquent que ces mécanismes sont multiples, mais nous ignorons lesquels jouent un rôle prépondérant chez l’homme, particulièrement dans le contexte des cancers. Notre équipe étudie les mécanismes immuno-suppresseurs des Tregs chez les patients cancéreux.
L’étude des Tregs humains est compliquée par l’absence d’un marqueur qui permet de clairement les distinguer des autres cellules du système immunitaire. Nous avons contourné ce problème en dérivant des clones de Tregs humains. Les clones représentent des populations de cellules tout à fait pures, qui peuvent être maintenues en culture in vitro pendant de longues périodes, fournissant un matériel très stable pour répéter des expériences et obtenir des résultats robustes et rigoureux. Nous utilisons nos clones de Tregs humains pour identifier des caractéristiques fonctionnelles propres aux Tregs, en les comparant à d’autres types de lymphocytes. Nous avons découvert que les Tregs, mais pas les autres lymphocytes, produisent une cytokine appelée TGF-ß. Les cytokines sont des substances (des protéines) sécrétées par les cellules immunitaires, qui exercent des effets à distance, sur d’autres cellules. Le TGF-ß est une cytokine aux propriétés immuno-suppressives bien connues. Il pourrait donc représenter un médiateur important de la fonction de Tregs. Nous avons également découvert que les Tregs utilisent GARP, une protéine ancrée à leur surface, pour réguler la production de TGF-ß. Nos travaux en cours visent à préciser les rôles de GARP et du TGF-ß dans l’activité immuno-suppressive des Tregs humains.
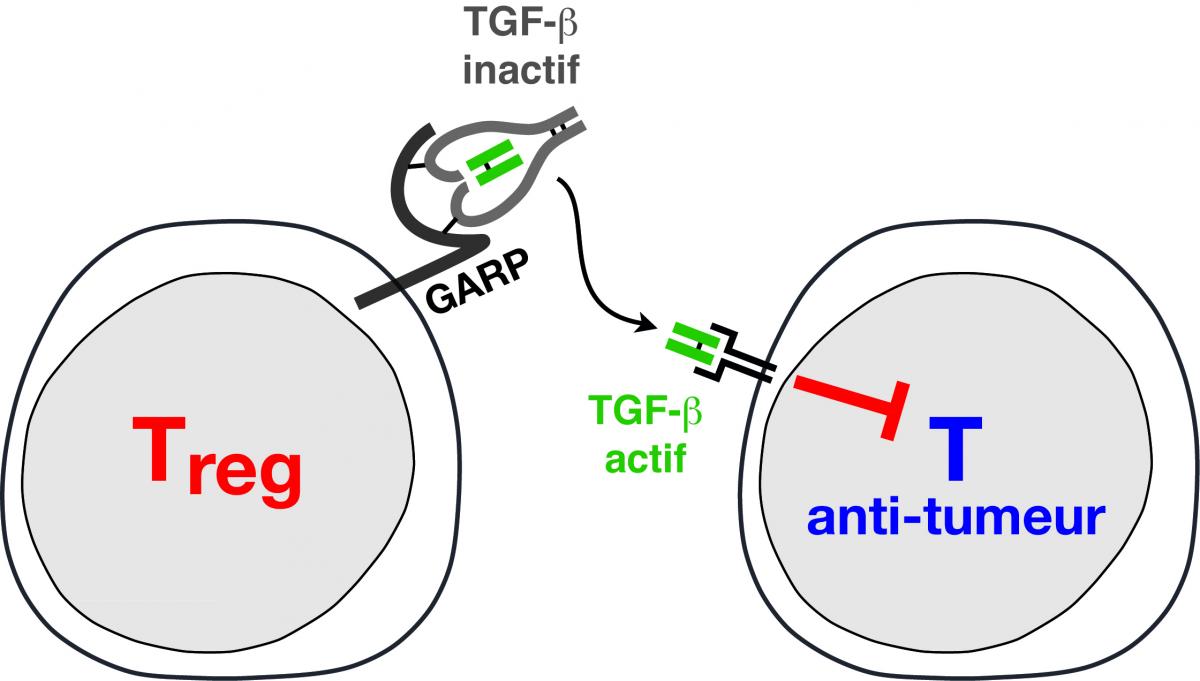
Légende
Les Tregs sont des lymphocytes T très particuliers. Ils inhibent les réponses immunitaires pour éviter les maladies auto-immunitaires. Chez les patients cancéreux, ils favorisent la progression des tumeurs en supprimant les réponses immunitaires dirigées contre les cellules cancéreuses : les Tregs inhibent les lymphocytes T anti-tumeur. Nous étudions comment les Tregs humains inhibent les réponses immunitaires anti-tumorales. Plus précisément, nous étudions comment GARP, une protéine à la surface des Tregs, contrôle la production de TGF-ß, une cytokine aux propriétés immuno-suppressives très puissantes.
Regulatory T cells, or Tregs, are a subset of CD4+ lymphocytes specialized in the suppression of immune responses. They prevent the occurrence of auto-immune diseases, but in mice they were also shown to contribute to cancer progression by inhibiting anti-tumor immune responses. Tregs could play a negative role in cancer patients, but this has remained difficult to verify due to the lack of a Treg-specific marker in humans, as well as to an incomplete understanding of the mechanisms underlying their suppressive function.
We succeeded in deriving stable human Treg clones, representing long-term cultures of pure lymphocyte populations available for repeated analysis. A stable epigenetic mark unambiguously distinguished human Treg clones from non regulatory T cells: a conserved non-coding region in gene FOXP3, encoding a transcription factor indispensable for the development and function of Tregs, was found demethylated in Treg clones only.
Our objectives are twofold: develop tools to quantify Tregs in human tissues, and identify mechanisms important for their suppressive function, which could be specifically targeted to improve the efficiency of cancer vaccines.
Quantification of Tregs in human tissues
We set up a methylation-specific real-time PCR assay to quantify demethylated FOXP3 sequences, indicative of the presence of Tregs. We used this assay to measure Treg frequencies in the blood of patients who received tumor vaccines in combination with different potentially Treg depleting agents. None of the agents tested induced a significant decrease in Treg frequencies in a majority of patients. We attempted to use our assay to measure Treg frequencies directly inside tumor samples. But we observed that melanoma cells themselves could harbor demethylated FOXP3 sequences, probably as a consequence of aberrant methylation patterns that frequently occur in human tumors. This observation precludes the use of FOXP3 demethylation as a marker of Treg cells in tumors, unless tumor-infiltrating T cells are separated from tumor prior to analysis. More recently, we used our assay in collaboration with the group of Frédéric Baron (GIGA, University of Liège), to measure proportions of Tregs in clinical-grade preparations of human Tregs infused in NSG mice to prevent xenogeneic Graft versus Host Disease (GvHD).
Mechanisms of immune suppression by human Tregs
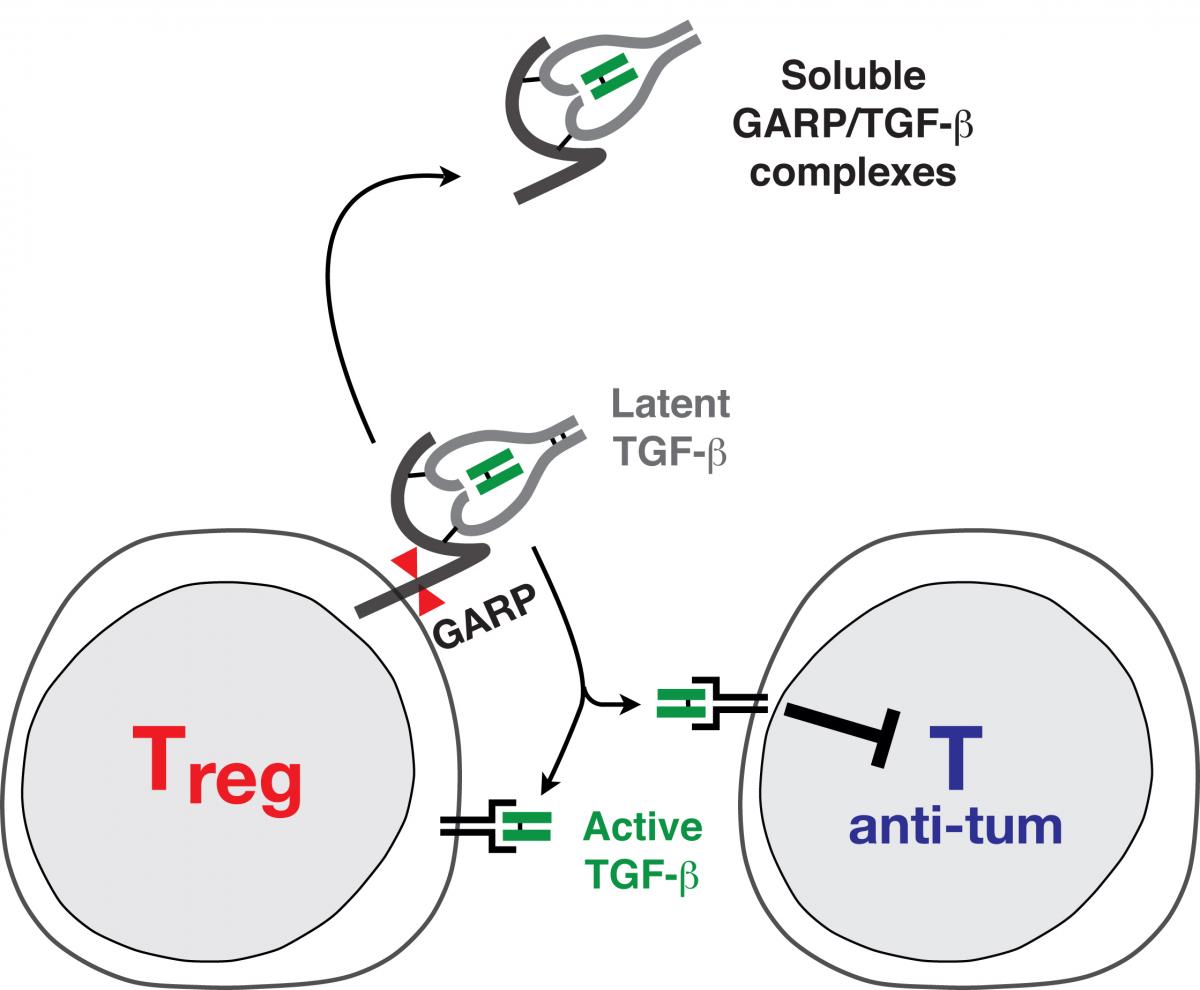
Functional analysis of our Treg clones revealed that a hallmark of stimulated human Tregs is to produce the active form of TGF-ß, a cytokine with well-known immunosuppressive actions. We are currently attempting to identify the mechanisms by which human Tregs can produce active TGF-ß.
Many cell types produce the latent, inactive form of TGF-ß. In latent TGF-ß, the mature TGF-ß protein (in green in Fig. 1) is bound to the Latency Associated Peptide, or LAP (in grey in Fig. 1), and is thereby prevented from binding to the TGF-ß receptor. We recently showed that latent TGF-ß binds to GARP, a transmembrane protein which is present on the surface of stimulated Tregs but not on other T cells. We hypothesize that membrane localization of latent TGF-ß through binding to GARP is required for activation of the cytokine by Tregs. We also observed that Tregs secrete a new form of soluble latent TGF-ß, in which it is disulfide-linked to GARP (Fig. 1). Secretion of soluble GARP/TGF-ß complexes, possibly through shedding form the cell surface, appears to be specific of the T cell lineage (12). We are currently trying to understand what function these new types of complexes could exert.
Gauthy E, Cuende J, Stockis J, Huygens C, Lethé B, Collet JF, Bommer G, Coulie PG, Lucas S.
PLoS One. 2013; 8(9):e76186.
Lucas S, van Baren N, de Smet C, Coulie PG.
Int J Cancer. 2012; 130(8):1960-6.
de Vries IJ, Castelli C, Huygens C, Jacobs JF, Stockis J, Schuler-Thurner B, Adema GJ, Punt CJ, Rivoltini L, Schuler G, Coulie PG, Lucas S.
Clin Cancer Res. 2011; 17(4):841-8.
Stockis J, Colau D, Coulie PG, Lucas S.
Eur J Immunol. 2009; 39(12):3315-22.
Stockis J, Fink W, François V, Connerotte T, de Smet C, Knoops L, van der Bruggen P, Boon T, Coulie PG, Lucas S.
Eur J Immunol. 2009; 39(3):869-82.
Lucas S, Coulie PG.
Semin Immunol. 2008; 20(5):301-7.
Lucas S, Ghilardi N, Li J, de Sauvage FJ.
Proc Natl Acad Sci U S A. 2003; 100(25):15047-52.
Chomez P, De Backer O, Bertrand M, De Plaen E, Boon T, Lucas S.
Cancer Res. 2001; 61(14):5544-51.
Lucas S, De Plaen E, Boon T.
Int J Cancer. 2000; 87(1):55-60.
Lucas S, Brasseur F, Boon T.
Cancer Res. 1999; 59(16):4100-3.
Lucas S, De Smet C, Arden KC, Viars CS, Lethé B, Lurquin C, Boon T.
Cancer Res. 1998; 58(4):743-52.

LES LYMPHOCYTES T REGULATEURS ET LE TGF-β